TUMORES GERMINATIVOS DOS TESTÍCULOS
Os tumores de testículo representam apenas 1% de todas as neoplasias que atingem os homens, mas constituem a doença maligna mais freqüente no jovem e, por isso, adquirem grande relevância clínica. Ademais, merecem toda a atenção médica pelo seu enorme potencial de cura, já que cerca de 90% dos pacientes sobrevivem à doença. Mais de 95% dos tumores de testículo são representados pelas neoplasias do epitélio germinativo e a elas nos referiremos no presente capítulo.
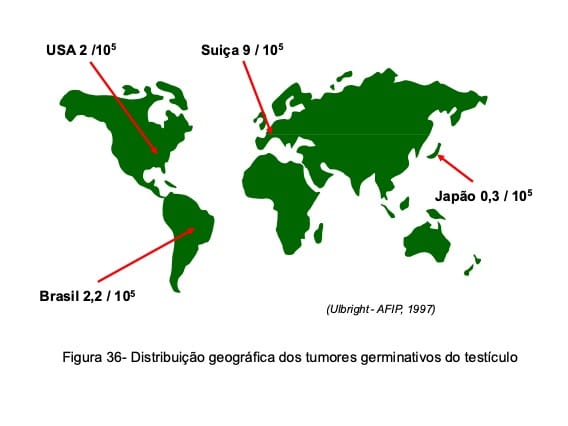
De forma inexplicável os tumores germinativos do testículo apresentam uma distribuição geográfica peculiar, sendo freqüentes em países do norte da Europa e raros no Extremo Oriente (Fig. 36).
CLASSIFICAÇÃO EPIDEMIOLÓGICA
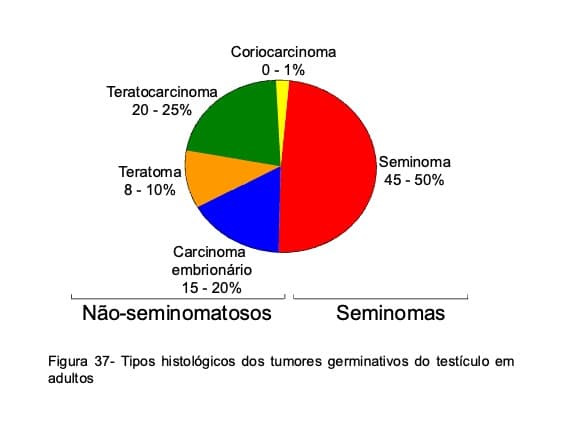
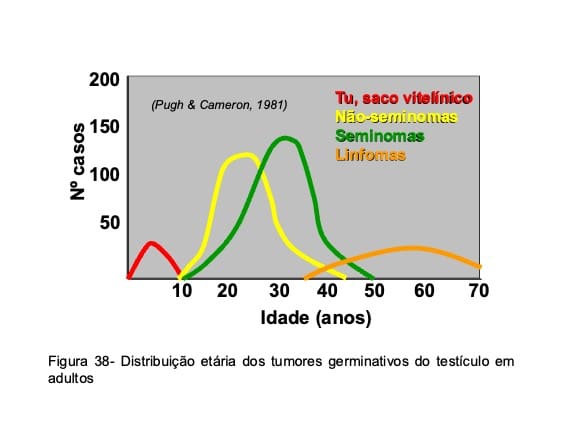
Os tumores germinativos do testículo (TGT) são divididos em dois grupos, que relaciona a histologia com o comportamento biológico da lesão: seminomas e não-seminomas (Fig. 37). Os seminomas, responsáveis por cerca de 50% dos casos em adultos, acometem indivíduos entre 25 e 40 anos e os tumores não-seminomatosos, que incluem o carcinoma embrionário, os teratocarcinomas, os teratomas, os tumores do saco vitelineo e os coriocarcinomas, correspondem a outra metade dos casos e incidem em indivíduos entre 18 e 30 anos (Fig. 38). Por motivos desconhecidos, os TGT são mais raros em negros, estimando-se que a proporção de casos brancos para negros seja, respectivamente de cinco para um.
Os tumores germinativos do testículo surgem em 1:50.000 homens e esta incidência aumenta para cerca de 1:1.000 em casos de criptorquidia ou atrofia testicular.
ETIOLOGIA
Os mecanismos implicados com o desenvolvimento dos TGT são desconhecidos, sabendo-se que a doença é muito mais comum em indivíduos com criptorquidia, atrofia testicular e, talvez, naqueles com antecedentes maternos de ingestão de estrógenos no período gestacional. Ademais, alguns estudos demonstraram que pacientes com AIDS apresentam maior incidência de tumores germinativos, que é de quatro a seis vezes mais comum nesses casos.
A ocorrência de TGT em membros de uma mesma família estimulou a pesquisa de alterações genéticas implicadas com o desenvolvimento destes tumores. Dessa forma, verificou-se que todos os pacientes com TGT evidenciam um isocromossomo no braço curto do cromossomo 12 (12p), com excesso de material genético localizado nesse segmento, o que sugere a presença local de protoncogene específico. A este defeito associam-se, freqüentemente, perdas de segmentos cromossômicos no braço longo do cromossomo 12q, indicando a existência nesta região de possíveis genes supressores da neoplasia.
HISTÓRIA NATURAL
Na apresentação inicial, cerca de 85% dos TGT evidenciam doença localizada e 15% demonstram metástases à distância. Este último fenômeno é três vezes mais comum nos tumores não-seminatosos, que tendem a ser mais agressivos que os seminomas (Tabela 13).
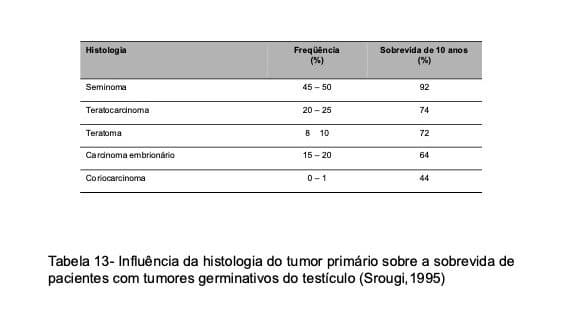
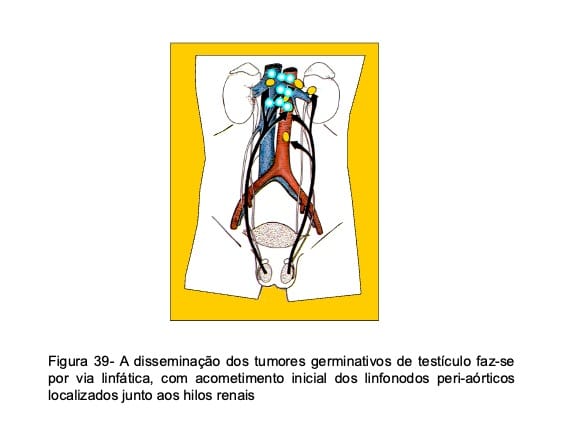
O desenvolvimento de metástases nesses pacientes obedece a um padrão constante de comportamento e inicia-se por envolvimento linfático do cordão espermático, com aparecimento de depósitos tumorais nos linfonodos peri-aórticos localizados na altura dos vasos renais. Deste ponto, a neoplasia progride cranialmente, em direção ao mediastino e pulmão, ou caudalmente em direção os vasos ilíacos (Fig. 39). A disseminação hematogênica faz-se principalmente para o pulmão e ocorre preferencialmente nos casos de coriocarcinoma. Raramente são acometidos outros órgãos e quando isto acontece, surgem lesões no fígado e no cérebro. As metástases, tanto linfáticas como hematogênicas, manifestam-se quase sempre antes de três anos do diagnóstico inicial nos tumores não-seminomatosos e antes de cinco anos nos seminomas. Dessa forma, os pacientes apresentam elevadas chances de cura quando ultrapassam esses períodos sem recorrência da doença.
A análise do subtipo histológico nos casos de tumor germinativo do testículo tem várias implicações prognosticas e terapêuticas. Com certa freqüência, os tumores não-seminomatosos surgem associados a seminomas. Nesses casos, o tratamento deve ser orientado de acordo com as regras adotadas em tumores não-seminomatosos, que constituem o componente mais agressivo e que determinam a evolução do paciente. Essa mesma orientação deve ser instituída nos casos de seminomas com alfa-fetoproteína elevada. Como os seminomas puros nunca produzem esse marcador, níveis aumentados do mesmo indicam a existência de elementos não-seminomatosos no tumor, não identificados pelo patologista.
Os seminomas apresentam uma variante menos freqüente chamada de seminoma espermatocítico (4% do total), que incide em homens mais idosos (mediana de 60 anos) e que tem um comportamento biológico extremamente favorável, já que não produz metástases. Esses pacientes são curados com a orquiectomia, não havendo necessidade de se instituir qualquer tratamento complementar.
Os teratomas maduros, constituídos por elementos celulares diferenciados, podem se acompanhar de metástases em 10% a 30% dos pacientes adultos, contrastando com a evolução totalmente benigna que evidenciam nas crianças. Devem, portanto, ser tratados em adultos de acordo com os princípios que regem o tratamento dos tumores não-seminomatosos.
Os coriocarcinomas puros caracterizam um subtipo bastante agressivo, de crescimento extremamente rápido e que produz metástases hematogênicas generalizadas. Esses pacientes necessitam, em geral, de terapêutica sistêmica mesmo quando a doença se apresenta inicialmente sob forma localizada.
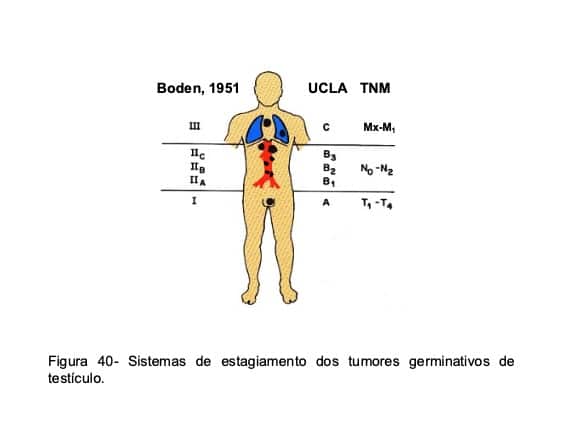
O prognóstico dos pacientes com TGT depende não apenas do tipo histológico da lesão, mas também da extensão inicial da doença, definida pelo estagiamento clínico (Fig. 40). Sob o ponto de vista prático, são mais empregadas às classificações de Boden e TNM, representadas na tabela 14. A sobrevida de 10 anos em pacientes com TGT oscila entre 90% a 100% nos casos em estágio I, entre 85% a 90% nos pacientes em estágio II e entre 60% e 85% nos doentes em estágio III.

CLÍNICA E DIAGNÓSTICO
Os TGT manifestam-se sob forma de aumento recentemente e indolor do volume testicular. Em 4% a 21% dos casos existe história de traumatismo local, prevalecendo atualmente o consenso de que o traumatismo não representa a causa do tumor, mas apenas chama a atenção do paciente para um processo já em desenvolvimento. Em alguns casos, o quadro inicia-se com dor aguda testicular, em decorrência de infarto e hemorragia intra-tumoral, levando ao diagnóstico incorreto de orquiepididimite aguda. Por isso, todo paciente jovem com manifestações escrotais que não melhoram após 10 dias de tratamento com antibióticos, deve ser reavaliado cuidadosamente e submetido a estudo de ultra-sonografia para se descartar neoplasia local.
Sintomas iniciais devidos à presença de metástases abdominais ou torácicas ocorrem em 4% a 14% dos pacientes, incluindo dor abdominal ou lombar intensa, desconforto respiratório ou massas cervicais.
Ao exame físico, os pacientes com TGT evidenciam massa testicular dura e pesada, que rebaixa o hemiescroto acometido e hidrocele, presente em 10% a 20% dos casos. Ginecomastia é encontrada em 2% a 10% dos pacientes e tende a desaparecer com a cura da doença.
O diagnóstico de TGT é cogitado quando lesão intratesticular é encontrada em exames de ultra-sonografia local. Esse método de imagem permite definir com bastante precisão a presença de tumores testiculares, que aparecem sob forma de lesões hipoecóicas homogêneas (seminomas) ou heterogêneas (não-seminomas).
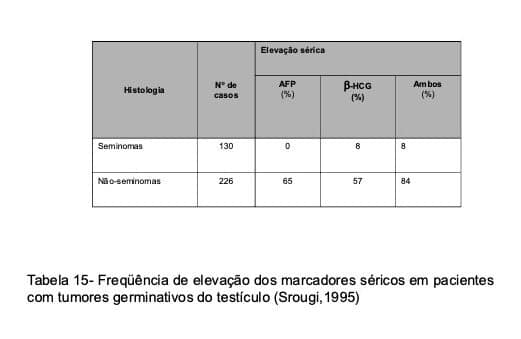
Os TGT têm a capacidade de sintetizar glicoproteínas atípicas que servem para caracterizar a presença e a atividade de neoplasias locais. Cerca de 8% dos seminomas produzem pequenas quantidades de gonadotrofina coriônica fração b (b-HCG) e aproximidade de 85% dos tumores não-seminomatosos secretam grandes quantidades de b-HCG e/ou de alfa-fetoproteína (AFP) (Tabela 15). Em pacientes com tumor primário não-tratado, elevações acentuadas da b-HCG e da AFP indicam, com certeza, a presença de elementos não-seminomatosos na lesão. A persistência de altos níveis desses marcadores após a remoção da lesão primária define, de forma quase certa, a presença de doença metastática, mesmo quando este quadro não pode ser confirmado pelos estudos de imagem. Raramente, resultados falso-positivos desses marcadores ocorrem em clínica, incluindo-se aqui a hepatite tóxica, os tumores primários do fígado ou raros tumores digestivos (falso-positivos para AFP) e os aumentos dos níveis de LH hipofisário por hipogonadismo ou por consumo de marijuana (falso-positivos para b-HCG).
Os níveis séricos de dehidrogenase láctica (DHL) elevam-se em 30% a 80% dos pacientes com TGT, incluindo os seminomas. Apesar de inespecífico, esse marcador acaba tendo grande valor prático, já que permite monitorizar pacientes com seminoma e, também, definir a extensão e o prognóstico da doença, uma vez que seus níveis séricos são proporcionais ao volume total de tumor.
A avaliação da extensão da doença (estagiamento clínico) é feita através de tomografia computadorizada do abdome e tórax, que permite identificar depósitos tumorais nos linfonodos retroperitoneais e em pulmão ou mediastino. Vale enfatizar que linfonodos com mais do que 2cm em retroperitônio indicam a presença quase certa de metástases locais. Quando os linfonodos têm entre 1 e 2 cm, a chance de existirem focos de doença metastática é de 50% a 70%.
TRATAMENTO
Tratamento do tumor primário
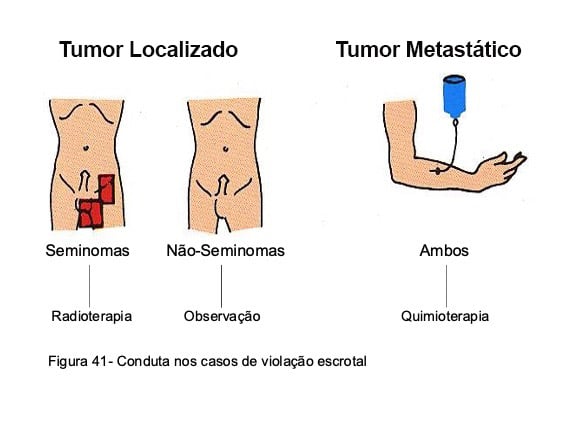
A lesão testicular primária deve ser removida por meio de orquiectomia realizada por via inguinal, com ressecção alta do cordão espermático. Quando a intervenção é executada por incisão escrotal, existe risco de derramamento de células neoplásicas, com recidiva local da neoplasia em 10% a 20% dos pacientes. Nos casos de violação dos envoltórios escrotais, impõe-se tratamento preventivo (Fig. 41), que em seminomas é feito por meio de radioterapia aplicada sobre o hemiescroto e região inguinal homolateral. Nos tumores não-seminomatosos até recentemente preconizava-se a realização de hemi-escrotectomia, mas o caráter mutilante deste procedimento fez com que na maioria dos centros, esses doentes passassem a ser acompanhados clinicamente, instituindo-se quimioterapia citotóxica nos casos de recidiva local comprovada. Em pacientes com doença metastática já presentes de início, o tratamento quimioterápico elimina os riscos de recidiva local e, por isso, as medidas acima descritas tornam-se desnecessárias.
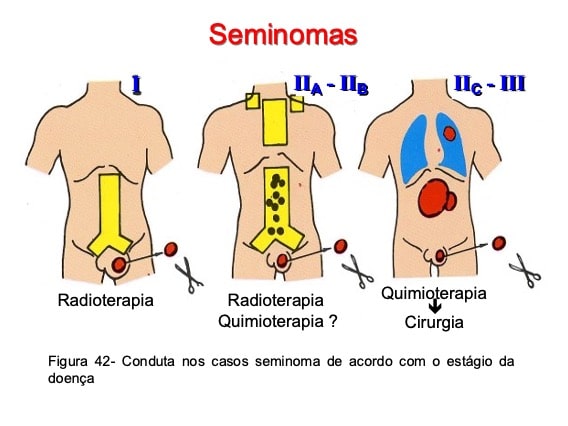
Tratamento dos seminomas
Metástases microscópicas em linfonodos retroperitoneais são encontradas em cerca de 10% dos pacientes com seminoma em estágio clínico I. Como os seminomas puros são bastante radiossensíveis, a radioterapia representa a principal forma de tratamento dos linfonodos retroperitoneais nos casos de doença local mínima, que incluem os estágios I e IIa (Fig. 42). Nos pacientes com estágios IIb, IIc e III, a radioterapia nem sempre elimina as lesões metastáticas, o que torna a quimioterapia citotóxica o método terapêutico preferencial para esses casos. O tratamento quimioterápico de primeira linha mais utilizado no momento incorpora a cisplatina, o ectoposide e a bleomicina (PEB), e seu emprego em casos de seminomas se acompanha de respostas completas e duradouras em 95% dos pacientes.
Nos pacientes com seminoma metastático e massas residuais pós-quimioterapia deve-se proceder a ressecção cirúrgica dessas lesões residuais se as mesmas tiverem mais do que 3 cm de diâmetro e observação vigilante quando as mesmas tem menos do que 3 cm.
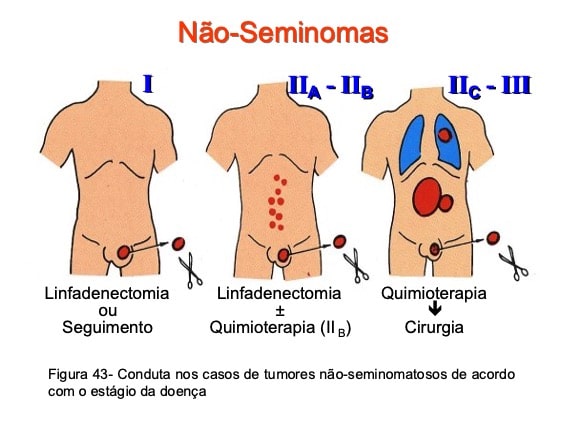
Tratamento dos tumores não-seminomatosos
Os tumores não-seminomatosos são relativamente radiorresistentes, de modo que a radioterapia não está indicada nesses casos. Os pacientes com doença em estágio I podem ser mantidos sob vigilância clínica, sem tratamento adjuvante, indicando-se a linfadenectomia retroperitoneal ou a quimioterapia citotóxica se surgirem evidências de metástases retroperitoneais ou à distância (Fig. 43).
Alguns pacientes em estágio I apresentam riscos elevados de portarem doença retroperitoneal microscópica, incluindo-se os tumores primários com invasão do cordão espermático, as neoplasias primárias acompanhadas de invasão vascular, pacientes cuja lesão primária tem mais de 50% de carcinoma embrionário puro e os pacientes com marcadores séricos iniciais acima de 1000. Nesses casos, deve-se realizar linfadenectomia retroperitoneal, que demonstra a presença de metástases microscópicas em 40 a 50% dos pacientes.
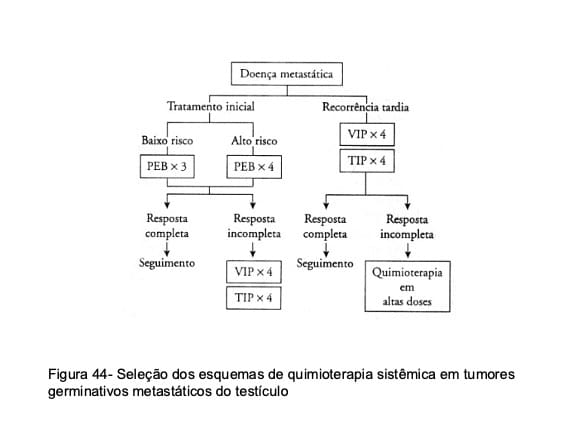
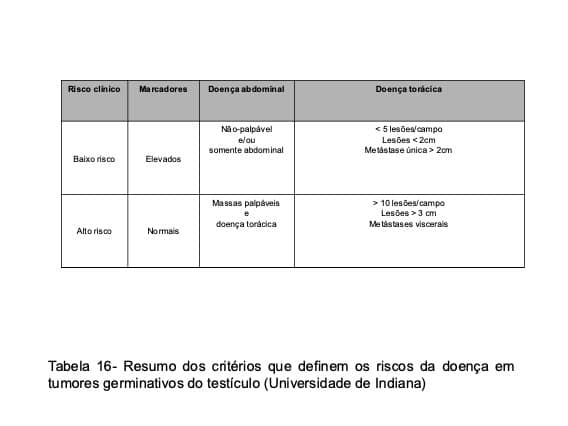
Neoplasias em estágios IIb, IIc e III costumam ser eficientemente controladas com quimioterapia citotóxica, que promove regressão completa das metástases em 60% a 95% dos casos. O esquema PEB é recomendado como tratamento de primeira linha, podendo-se recorrer às associações de ectoposide, ifosfamida e cisplatina (VIP), de taxol, ifosfamida e cisplatina (TIP) ou de carboplatina, ectoposide e ciclofosfamida em altas doses (com transplante de medula), nos pacientes com doença de alto risco (Tabela 16) ou com persistência/progressão da neoplasia após o emprego do esquema de primeira linha (Fig. 44).
Nos pacientes com tumor não-seminomatoso metastático, todas as massas residuais após a quimioterapia devem ser ressecadas cirurgicamente, já que cerca de 60% delas evidenciam elementos tumorais viáveis malignos ou benignos (teratoma), cuja remoção contribui erradicar de forma completa a doença.